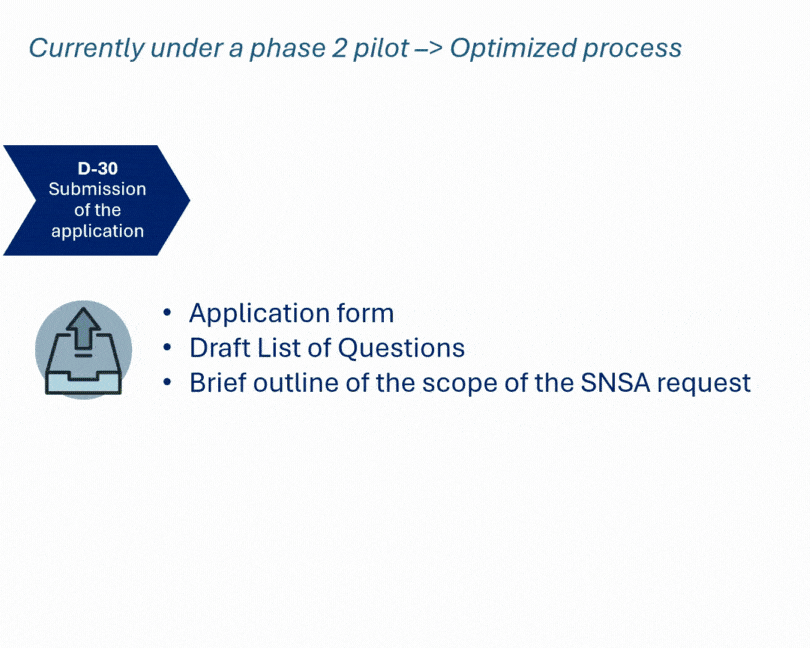
Cette démarche coordonnée a permis d’aborder de manière structurée les aspects CMC, non cliniques et cliniques, là où les guidelines étaient peu précises. Résultat : une vision plus claire et sécurisée du plan de développement, en cohérence avec les attentes des autorités.
🔗 En savoir plus sur le SNSA
– Anne Walter

Présents à la conférence RAPS Euro Convergence 2024 à Bruxelles, nous avons échangé autour des grandes évolutions réglementaires à venir. Réforme européenne, accès aux traitements et transformation digitale étaient au cœur des débats. Un moment riche pour partager et anticiper l’avenir du réglementaire.


La restitution de cette journée a rencontré un franc succès, grâce notamment à l’intervention de notre collègue Lorraine Balin, qui a brillamment présenté les évolutions réglementaires majeures et les implications pour l’industrie. Son expertise a permis d’éclairer les participants sur les bonnes pratiques à adopter et les perspectives à venir.
Pour prolonger cette dynamique, nous mettons à disposition une infographie récapitulative des temps forts réglementaires abordés lors de cette session. Un outil synthétique et pédagogique pour garder en mémoire les points clés de cette journée d’échanges.
